醫療器械唯一標識(UDI),并不是醫療器械行業近幾年新誕生的要求,而在ISO 13485體系中本身就有可追溯性要求的要素,但從行業發展的觀點看,UDI是全球性的醫療器械唯一標識系統,也是全球醫療器械市場國際化發展的必然趨勢。本文從UDI的定義、UDI的范圍和要求、UDI的重要性、UDI的掃描設備及實施UDI的困難與挑戰,七個方面進行綜述,供醫療器械從業人員的愛好者學習,借鑒。
Unique device identification (UDI) 是美國食品藥物管理局FDA建立的”特殊醫療器械的識別系統”,該注冊碼的實施是為了有效識別在美國市場上銷售并使用的醫療器械,無論其生產地在哪里。一旦實施,NHRIC和NDC標簽將廢止,所有的醫療器械都需要將這個新的注冊碼作為標識貼在產品的外包裝上。除了滿足可見(visible)之外,UDI必須滿足純文本形式和自動識別技術(automatic identification and data capture, AIDC). 器械的標簽負責人員也必須將每個產品的確實信息發送到“FDA國際特殊醫療器械識別庫UDID”內,使公眾可以通過訪問該數據庫查詢并下載相關數據(包括從生產,分銷到客戶使用情況的信息等),但該數據庫不會提供器械使用者的信息。
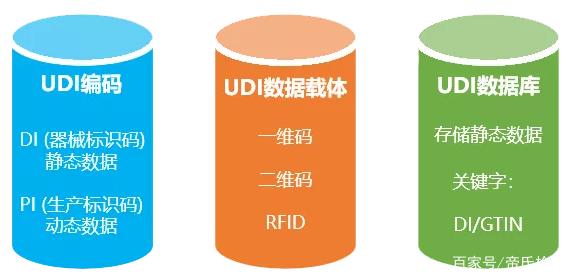
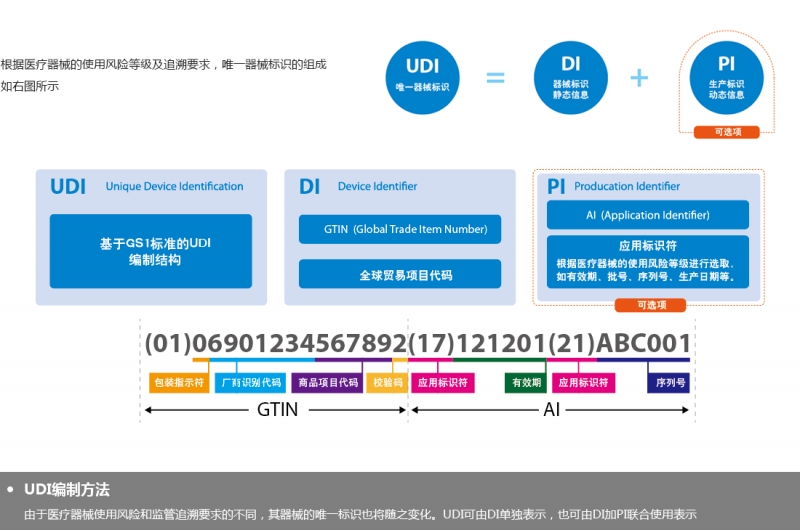
主要是一個由數字或字母組成的編碼。由器械識別碼(DI)和生產識別碼(PI)組成。
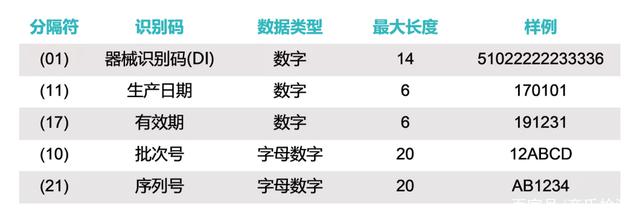
器械識別碼是強制固定的編碼,包含了標簽管理人員的信息、設備特定版本或型號,而產品識別碼不受特別規定,包含了器械生產批號、序列號、生產日期、失效日期以及作為器械管理的生命細胞組織產品的特有識別碼。
其次說說GUDID,Global Unique Device Identification System (GUDID), FDA國際特殊醫療器械識別庫。數據庫通過AccessGUDID查詢系統對外公開。不但可以直接在數據庫網頁輸入標簽信息中的UDI的DI碼找到產品信息, 還可以通過任一醫療器械的屬性搜索(例如儀器識別碼Device identifier, 公司或商品名稱,通用名稱或者器械的型號、版本),但值得注意的是,該數據庫不提供器械的PI碼。
即UDI定義:唯一器械標識(Unique Device Identification,縮寫UDI)是對醫療器械在其整個生命周期賦予的身份標識,是其在產品供應鏈中的唯一“身份證”。全球采用統一的、標準的UDI有利于提高供應鏈透明度和運作效率;有利于降低運營成本;有利于實現信息共享與交換;有利于不良事件的監控和問題產品召回,提高醫療服務質量,保障患者安全。
1、器械識別碼:
? 器械的版本號或型號
?器械貼標者(使標簽置于器械上、使標簽修改、或者使器械引入商業的人)
2、生產識別碼:
(1)例如批號或批次、序列號、到期日期、生產日期;對于被作為醫療器械監管的人體細胞、組織、或細胞和組織產品,要求使用特定的識別碼。除了特定的器械識別碼,還需要將有關器械的信息輸入到GUDID,其中包括器械識別碼,以及下列內容的每一項。生產識別碼是不需要的;
(2)如果器械使用直接標識, 并且直接標識與器械標簽上的標識不一致,需要說明哪一個為器械識別碼;
(3)之前的器械識別碼(如果貼標器械為新版本或新型號);
(4)器械版本或型號;
(5)標簽上的生產識別碼的類型;
(6)FDA市場準入的類型及編號,和列名編號;
(7)基于“全球醫療器械命名系統(GMDN)”的產品代碼;
(8) FDA產品代碼;
(9)每個包裝內的單個器械的數量。
FDA在發布UDI法規提案時,確定了幾個目標。
1.減少醫療差錯;
2.簡化將器械使用信息集成到數據系統的操作;
3.更加迅速地識別出現不良事件的醫療器械;
4.更加迅速地為已報告的問題制定解決方案;
5.提供更加迅速、更有效的器械召回解決方案;
6.實現更加重點突出且有效的FDA安全溝通;
7.輕松訪問明確器械標識信息的原始來源。
根據UDI最終法規, UDI將會大大減少對美國市場中的醫療器械進行充分識別的障礙。因為UDI可以迅速并明確地識別出器械安全和有效性的關鍵屬性,所以UDI的出現會大大減少此類醫療差錯。這是因為這些差錯可能是由于器械標識不當或有關其恰當使用的困惑而引起。
UDI系統的優勢將會逐步在醫療分配系統中體現出來。各大醫療器械體系在推廣UDI的介紹詞中都包括了安全性,可追蹤性,高效性。
該UDI系統能夠提高用戶的安全、新型醫療器械售后監管和幫助醫療器械的革新。考慮到使用者的安全,當UDI系統完備后,有質量風險的醫療器械將會更容易被追蹤和監控,對于不良事件的反饋可以更加有效,審查和分析更加準確,有助于使用者最快時間內解決安全隱患,同時也便于醫療保險的清算。一旦假冒偽劣產品流入市場,查詢GUDID數據庫關于銷售網絡的情況,便于使用者判斷產品真偽。
UDI系統的出臺,另一方面也促進了生產企業的轉型,對于產品召回和安全隱患帶來的利益損失,督促企業完善質量管理體系,保證產品的有效和安全。
UDI識別碼正逐步在世界范圍內被接納,作為提高不良反應事件的報告質量,明確醫患糾紛和管理醫療器械分銷網絡的利器,盡管對于醫療器械生產商來說投入頗大,但不可忽視的是,其對于病人安全的重要保護和醫療器械國際化的監管優化。
1.費用龐大。根據EUcomed 關于2020年前企業UDI建立所耗費的資金調研,整個產業估計耗費涉及10億歐元。
2. 關于UDI的法規不完善。我國的UDI編碼方案正在開展。
3. 思想的轉變。很多醫院只是滿足內部需求,在編碼上沒有采用統一標準的意識。很多企業和醫療行業未認識到醫療器械追溯和維修,這樣一整個完整體系建立的必要性。
4、公司應積極應對,研究各目標市場,及早準備。
對公司而言,盡早制定出符合新UDI要求的策略至關重要。該策略需要包括如何識別所有產品的版本和型號、適用的分類、適用的現行標識方案,并且要對需要根據法規及時進行為滿足正確貼標而準備的內容進行差距分析。還必須確定公司將使用的條形碼技術、公司將會需要聘用的經FDA批準的號碼頒發機構、準備創建將在GUDID中記錄信息所需的賬戶、以及如何獲取合適的用于填充GUDID的資源。同時,公司可能需要確定符合標簽規定的標簽軟件程序包,并根據合規日期要求,公司為產品設計和實施新標簽所需的資源。